Le premier principe qui stipule la conservation de l'énergie permet de faire le bilan d'énergie des systèmes, sans imposer de conditions sur les types d'échanges possibles. Mais, ce bilan énergétique ne permet pas de prévoir le sens d'évolution des systèmes.
ex.: sens des réactions chimiques ou des transformations naturelles , ou le transfert spontané de la chaleur du chaud vers le froid
Le premier principe par son bilan n'exclut pas le transfert de la chaleur du froid vers le chaud (ce qui est impossible) et il n'explique pas l'irréversibilité de certaines transformations spontanées ou naturelles.
Il faut donc introduire un deuxième principe dit aussi principe d'évolution, déduit des faits expérimentaux, qui permettra de prévoir l'évolution des systèmes. Le deuxième principe introduit une nouvelle fonction d'état dite entropie S qui décrit le comportement des systèmes par la maximalisation de leur entropie:
Certaines transformations naturelles sont irréversibles: elles n'évoluent que dans un seul sens.
-ex.1: la détente d'un gaz, caractérisée par:
|
Fig. 6.1: Détente irréversible d'un gaz |
- l'écoulement brusque du gaz d'une HP -> BP - la détente est spontanée et irréversible |
On remarque que:
Cet état final 2 est plus désordonné (mélange homogène) et surtout cet état est stable.
-ex.2: le transfert spontané de la chaleur, caractérisé par:
|
Fig. 6.2: Transfert de chaleur |
- l'écoulement de la chaleur des HT -> BT - ce transfert est spontané et irréversible |
Dans cet état final d'équilibre, les molécules ont en moyenne même énergie cinétique et le système est caractérisé par un plus grand désordre.
-ex3: une roue de voiture en mouvement est freiné progressivement jusqu'à son arrêt, avec comme résultat un échauffement des freins et de la jante
|
Fig. 6.3: Freinage d'une roue |
- jamais, on ne voit cette roue se mettre seule en mouvement en absorbant la chaleur dégagée par le freinage et remonter la pente |
* Ces processus naturels sont irréversibles et respectent le premier principe (énergie conservée), comme d'ailleurs les processus inverses qui sont impossibles. Le premier principe n'exclut donc pas ces transformations inverses : mais, il n'explique pas leur sens privilégié et leur donc leur irréversibilité.
On a vu dans les deux exemples précédents que les sytèmes évoluent vers un plus grand désordre pour atteindre un état final stable ou état d'équilibre :
=> les transformations irréversibles sont spontanées et elles satisfont à la règle d'augmentation de l'entropie des systèmes, qui prend sa valeur maximale à l'équilibre.
* Le premier principe considère toutes les transformations comme également possibles: il ne tient pas compte du caractère irréversible d'une transformation et ne se prononce pas sur la notion d'irréversibilité des transformations spontanées. Il exclut le mouvement perpétuel de premier espèce c.à.d qu'on ne peut indéfiniment fournir de l'énergie sous une certaine forme sans en consommer ailleurs sous une autre forme.
* Le deuxième principe va définir le sens privilégié suivant lequel les transformations peuvent se dérouler et préciser les conditions d'équilibre du système. C'est un postulat basé sur des observations expérimentales.
La thermodynamique classique ne cherche pas à expliquer le sens privilégié des transformations naturelles ou spontanées, mais elle postule simplement l'irréversibilité de ces transformations observées expérimentalement.
![]() Enoncé de Clausius (déduit de l'exemple 1)
Enoncé de Clausius (déduit de l'exemple 1)
|
Fig. 6.4: Processus de transfert de chaleur impossible |
Une quantité de chaleur ne peut jamais être transférée spontanément d'une source froide(BT) vers une source chaude (HT) |
* Si l'interdiction de Clausius n'existait pas, on pourrait alors extraire p.ex sans dépense d'énergie l'énergie calorifique des océans, des fleuves ou de l'air pour faire bouillir de l'eau et ainsi faire fonctionner gratuitement des turbines à vapeur pour disposer d'énergie mécanique et électrique gratuite !!!
![]() Enoncé de Kelvin (déduit de l'exemple 3)
Enoncé de Kelvin (déduit de l'exemple 3)
|
Fig.6.5: Production de travail impossible |
Il est impossible de prélever une quantité de chaleur Q d'une source d'énergie et de la transformer intégralement en travail |
* Sans cette impossibilité, on pourrait construire un moteur qui pomperait de la chaleur d'une source (océan) et de la transformer complètement en travail pour faire avancer un navire !!!
Compte tenu des deux postulats de Clausius et de Kelvin, imaginons un cycle de transformations au cours duquel :
|
Fig. 6.6 : Cycle imaginaire d'une machine fictive |
- le bilan d'énergie de cette machine s'écrit: å dQ/T = Q/T2 - Q/T1 > 0 car T1 > T2 |
=> Etant donnné que le processus précédent est impossible (selon Clausius), on en déduit que pour un cycle réel d'une machine, il faut donc que :
![[ ]](image364.gif)
6.1)
La relation 6.1) est l'énoncé mathématique du deuxième principe déduit des postulats d'irréversibilité.
![]() Transformations réversibles
Transformations réversibles
L'équation 6.1) va nous permettre de définir une nouvelle fonction d'état du système, appelée entropie S. Considérons un cycle thermodynamique formé de deux transformations réversibles: la somme de l'expression 6.1) peut alors être remplacée par une intégrale.
|
Fig. 6.6: Cycle réversible |
d'où, ![[ ]](image365.gif) 6.2) 6.2)soit, Þ ![[ ]](image366.gif) |
finalement, on a : ![]()
![[ ]](image367.gif)
![]()
6.3)
De la relation 6.3, on déduit que l'intégrale pour une transformation réversible ò AB dQrev /T:
Cette intégrale peut donc être considérée comme résultant de la variation d'une grandeur S, appelée entropie, définie par :
D S = SB- SA = ò AB dS = ò AB dQrev /T
6.4)
|
et par conséquent, |
dS = dQrev /T |
6.5) |
où dS est une différentielle exacte et donc l'entropie S est une fonction d'état
![]() Transformations irréversibles
Transformations irréversibles
Considérons le cycle irréversible formée d'une transformation réversible AB et d'une transformation irréversible BA. D'après la relation 6.1) on a alors:
![[ ]](p6-8.gif) |
![[ ]](image368.gif) soit, å AB dQ/T - ò AB dQrev /T < 0 |
finalement, pour une transformation irréversible, on a:
å AB dQ/T < SB - SA
6.6)
c.à.d, D S > å AB dQ/T ou dS > dQirr/T
6.7)
pour une transformation irréversible élémentaire, on a donc:
dS = dQirr/T + s
6.8)
où s est une source d'entropie caractérisant l'irréversibilité de la transformation: il y a création d'entropie.
![]() Cas général: deuxième principe
Cas général: deuxième principe
La relation dS = dQirr/T + s
est l'énoncé le plus général du deuxième principe, avec s = 0 pour une transformation réversible et s ¹ 0 pour une transformation irréversible.
" La variation d'entropie d'un système thermodynamique ne peut être que positive ou nulle "
Remarque:
La différentielle dS est une différentielle totale exacte, alors que dQ n'est pas une différentielle exacte: le facteur 1/T appliqué à la forme différentielle dQ la transforme donc en différentielle totale exacte. On dit que 1/T est un facteur intégrant de la forme différentielle dQ.
![]() Cas particuliers
Cas particuliers
a) Système isolé: dans un système isolé (adiabate et fermé) on a dQ = 0 et donc dS = 0.
" L'entropie d'un système isolé ne peut donc qu'augmenter ou rester constante "
b) Transfert spontané de chaleur
Soit un système isolé séparé en deux compartiments (à température différente T2 > T1) par une cloison isolante (adiabatique). Si on enlève la cloison, dans quel sens va s'écouler la chaleur?
Supposons qu'une quantité de chaleur dQ passe du compartiment 1 vers le compartiment 2 et déterminons le signe de dQ:
|
Fig. 6.7: Transfert de chaleur dans un système isolé |
on a, dS1 = dQ/T1 et dS2 = dQ/T2 |
et la variation totale d'entropie du système isolé est donc: dS = dQ/(1/T1 - 1/T2)
or, pour un sytème isolé dS > 0 et comme T2 > T1, il en résulte que dQ > 0: c.à.d que le compartiment 2 reçoit bien de la chaleur.
Le deuxième principe explique donc le sens privilégié et irréversible de l'écoulement de la chaleur des hautes températures vers les basses températures.
Ce processus irréversible de transfert de chaleur se poursuivra jusqu'à l'égalité des températures dans les deux compartiments: alors, l'entropie du système isolé sera maximale et on aura atteint un état d'équilibre.

Le deuxième principe est étroitement lié à la notion de désordre. Ceci est bien illustré par l'exemple précédent du transfert de chaleur entre deux compartiments à température différente : où l'augmentation d'entropie du système isolé pour atteindre son état final d'équilibre correspond bien à la tendance naturelle de système à augmenter son désordre. En effet, dans l'état final les molécules du gaz sont bien mélangées et réparties de façon homogène et aléatoire dans toute l'enceinte: on a alors atteint un désordre maximum.
Or dans ce gaz, l'état macroscopique du gaz résulte d'un grand nombre d'états microscopiques caractérisés par des positions et vitesses individuelles des molécules différentes. Le but de la thermodynamique statistique est d'exprimer l'état microscopique au moyen des états microscopiques à partir des lois de la statistique:
Comme la probabilité thermodynamique W est l'expression du désordre moléculaire, on peut donc dire que l'entropie S est une mesure du désordre moléculaire.
Une transformation irréversible correspond alors au passage d'un état macroscopique à un autre état macroscopique dont la probabilité W est plus grande.
Une transformation réversible correspond par contre au passage à un état macroscopique dont la probabilité thermodynamique W est égale.
L'énoncé général du deuxième principe contient implicitement tous les énoncés classiques basés sur les cycles monothermes (énoncés de Clausius et Kelvin précédents) ou basée sur les cycles dithermes (cycle de Carnot). Un cycle monotherme ne fait intervenir des échanges d'énergie (Q,W) qu'avec une seule source de chaleur.
![]() Machines thermiques
Machines thermiques
Puisqu'il est impossible d'après ce deuxième principe de prélever de la chaleur d'une seule source de chaleur et de la transformer intégralement en chaleur, une machine thermodynamique doit donc nécessairement fonctionner entre au moins deux sources de chaleur :
- la transformation de chaleur en travail (Q ® W) à partir d'une source chaude n'est donc possible qu'à la condition de rejeter une partie de la chaleur à une autre source froide (cycle ditherme).
- cette chaleur rejetée est donc perdue et influera sur les performances de la machine thermique: d'où la notion de rendement thermique
A partir de ce schéma à deux sources (une source chaude ou froide), on définit deux types de machines thermiques: les machines thermo-dynamiques TD et les machines dynamo-thermiques DT, dont le principe de fonctionnement est illustré sur les Fig. 6.8 et 6.9.
![]() Machines thermo-dynamiques
Machines thermo-dynamiques
|
Fig. 6.8: Machines thermodynamiques TD |
1er principe : Q2 = W + Q1 2è principe : notion de rendement
|
![]() Machines dynamo- thermiques
Machines dynamo- thermiques
|
Fig. 6.9: Machines dynamo-thermiques DT |
1er principe: Q2 = W + Q1 2e principe: notion de coefficient de performance h
|
Les machines thermodynamiques sont des machines thermiques produisant du travail (machines motrices), c'est le cas :
Les machines dynamo-thermiques sont par contre des machines de tranfert de chaleur, exemple :
![]() Cycle de Carnot
Cycle de Carnot
Un cycle de Carnot est un cycle ditherme moteur réversible (Fig.6.10):
![[ ]](p6-c.gif)
Fig. 6.10: Cycle moteur réversible de Carnot
On réalise un tel moteur en enfermant une certaine masse m de gaz dans un cylindre fermé par un piston coulissant sans frottement. Au cours de ce cycle ABCDA, le gaz revient à son état intial après avoir :
L'énergie interne ne changeant pas au cours d'un cycle D U = UA - UA = 0, on a d'après le premier principe:
D U = Q2 + Q1 + W = 0 avec ½ W½ = Q2 - ½ Q1½
6.9)
Le rendement r du cycle de Carnot est alors défini par :
r = ½ W½ / Q2 = (Q2 - ½ Q1½ )/Q2 = 1- ½ Q1½ /Q2
6.10)
* On démontre que le cycle de Carnot est le cycle qui a le rendement maximun, aucun autre cycle d'une machine thermodynamique ne peut avoir un rendement plus grand.
Le cycle de Carnot est un cycle idéal et c'est pour cette raison que tous les autres cycles réels sont comparés au cycle de Carnot qui sert ainsi de référence.
On définit ainsi l'efficacité e d'un cycle quelconque comme le rapport du rendement de ce cycle au rendement de Carnot :
efficacité d'un cycle: e = r/rc (avec 0 < e <1)
![]() Température absolue
Température absolue
On montre que dans un cycle de Carnot: Q2/T2 + Q1/T1 = 0
6.11)
soit en valeur absolue, on a : Q2/ ½ Q1½ = T2/ T1
et par conséquent, le rendement du cycle de Carnot s'exprime simplement en fonction des températures des deux sources :
r = 1 - T2/T1
6.12)
La relation 6.12 devient alors une définition de la température absolue et puisque cette relation définit seulement le rapport des deux températures, il est nécessaire de fixer une origine de température (le point triple de l'eau ). Dans l'échelle absolue de Kelvin, la température du point triplede l'eau est 273,16 K.
D'après la formule de définition de l'entropie, D S = SB - SA = ò AB dS = ò AB dQ/T
- il suffira pour calculer la variation d'entropie d'un système entre deux états A et B, d'imaginer une transformation réversible allant de A vers B
- à 0K, les corps purs ont tous la même entropie S = 0, car à cette température tous les corps purs sont cristallisés et donc parfaitement ordonnés (W = 1 et donc S = 0)
Au cours d'une transformation élémentaire et réversible, on a :
dU = dQ + dW = dQ - pdV
soit pour l'entropie
dS = dQ/T = (dU + pdV)/T
6.13)
![]() Transformation isochore (V = cte)
Transformation isochore (V = cte)
alors, dS = dU/T = mcvdT/T
soit, D S = mcvlnT2/T1
6.14)
![]() Transformation isobare (p = cte)
Transformation isobare (p = cte)
alors, dS = (dH - Vdp)/T = mcpdT/T
soit, D S = mcplnT2/T1
6.15)
![]() Transformation isotherme (T = cte)
Transformation isotherme (T = cte)
dS = pdV/T = mrdV/V et D S = mrlnV2/V1
6.16)
car à T = cte et pour un gaz idéal: D U = D H = 0
![]() Transformation isentrope (S = cte): dS = 0 et S2 =S1
Transformation isentrope (S = cte): dS = 0 et S2 =S1
avec, Wvisen = U2 -U1 et Wtisen = H2 - H1
![]() Transformation polytrope
Transformation polytrope
alors, dS = dQ/T = mcv(n - g )dT/(n - 1)T
soit, D S = mcv(n - g )lnT2/T1/(n - 1)
6.17)
ou, D S = mcplnT2/T1 - mrlnp2/p1
6.18)

Ex1: Montrer que les énoncés de Clausius et de Kelvin sont équivalents. Pour cela, on considère le schéma à deux niveaux de température dans lequel:
Faites le bilan en énergie de ces deux opérations et dessiner le nouveau schéma en résultant. Conclusion.
Ex2: Cycle de Carnot. Montrer que le cycle de Carnot a le rendement maximun.
Supposons qu'il existe un autre cycle A avec un rendement supérieur à celui de Carnot. On dessinera dans le schéma à deux niveaux de température:
Faites le bilan d'énergie de ces deux cycles et concluer.
Ex3: Calculer dans le cas général (transformation quelconque), l'entropie d'un gaz parfait à partir de la définition de la variation d'entropie d'une transformation élémentaire et à partir du premier principe.
Ex4: Calculer dans chaque phase d'un cycle de Carnot d'une mole de gaz parfait,
a) le travail et la chaleur échangés avec le milieu extérieur
b) la variation d'entropie
c) montrer que VA/VD = VB/VC
d) calculer la variation totale d'entropie au cours du cycle, conclusion
Ex5: Un cycle de Carnot d'un gaz parfait diatomique comporte deux états extrèmes caractérisés par les valeurs suivantes des variables:
a) déterminer les coordonnées des points B et D du cycle
b) calculer le chaleurs Q2 et Q1 et le travail W
Rép: a) VA = 5,6 l , VB = 4,26 l , VD = 1,315 l et pD = 7,6 bar , PB = 1,315 bar
b) Q2 = 274 J Q1 = - 153 J et W = - 121 J
Les machines thermodynamiques fonctionnent avec plusieurs transformations successives et répétitives formant un cycle. Dans la pratique, ces transformations ne sont pas réversibles. On remplace alors ces processus irréversibles par des transformations réversibles plus facilement calculables: d'où on obtient des machines idéales qui donnent une première approche du problème.
En effet, pour qu'une machine thermique fonctionne de façon ininterrompue:
|
7.1 Transformation unique et cycle |
la transformation 1-2 n'est exécutée qu'une seule fois (le travail W n'est fourni une seule fois) |
* Pour réaliser un cycle, le système fermé ou ouvert doit être ramené dans son état initial par un processus adéquat: ceci est illustré dans les figures suivantes.
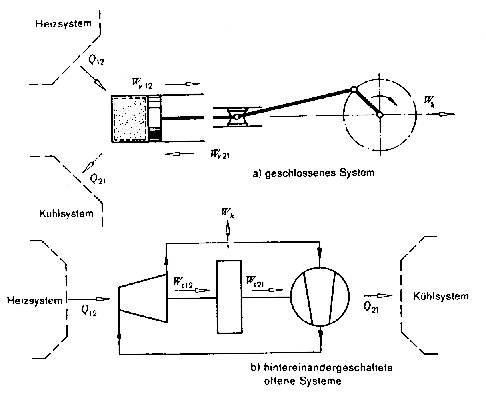
On considère un système effectuant un cycle réversible formé de deux transformations au cours desquelles le système échange de la chaleur et du travail avec le milieu extérieur.
|
Fig. 7.3: Cycle réversible |
Q12 + W12 = U2 - U1 Q21 + W21 = U1 - U2 |
En additionnant ces deux équations, on obtient:
W12 + W21 = -(Q12 + Q21)
1)
En désignant par Wk la somme de tous les travauux effectués au cours d'un cycle et en appelant Wk le travail utile du cycle, on a de façon très générale pour un cycle quelconque :
Wk = å W = å Q
2)
où, W est soit le travail volumétrique Wv pour un système fermé ou soit le travail technique Wt pour un système ouvert
![]() Convention de signes
Convention de signes
|
Fig. 7.4a: Machines TD |
Fig. 7.4b: Machines DT |
Les cycles sont formés par la succession de plusieurs transformations et sont représentés dans un diagramme soit en coordonées (p,V) ou (T,S) ou (p,H). Ces diagrammes permettent de suivre l'évolution du fluide et de visualiser les énergies échangées.
Dans les machines thermo-dynamiques TD, de la chaleur est transformée en travail. Cette chaleur est fournie à partir de combustibles fossiles ou nucléaires ou à partir d'énergie solaire ou géothermique: elle est transférée au fluide de travail (eau, air...) à la température la plus élevée possible. Ces machines sont des systèmes fermés où le fluide revient à son état initial après diverses transformations successives.
Dans les moteurs à combustion, de l'énergie contenue dans le carburant est libérée par réaction chimique avec l'air enfermé dans un cylindre et le mélange change de composition. Ces machines sont des systèmes ouverts auxquels on amène de l'air et un carburant et on rejette les gaz brûlés à l'atmosphère.
On peut traiter ces diverses machines thermiques à partir de cycles thermodynamiques où les processus réels irréversibles sont remplacés par des processus simplifiés et réversibles. Ces transformations réversibles représentent alors une machine idéale sans perte de chaleur par frottement.
Dans les systèmes ouverts, on simplifie en idéalisant le fonctionnement de la machine c.à.d en remplaçant l'arrivée et le rejet de gaz dans la machine par un apport et une cession de chaleur par échange: on néglige ainsi les changements de composition chimique du gaz liés à la combustion.
Les fluides de travail (vapeur d'eau, air ou gaz...) dans ces machines sont assimilés à des gaz parfaits, ce qui est à peu près le cas dans les domaines de pression et température considérés.
Le cycle de Carnot est le cycle à rendement maximun et sert de ce fait de cycle de référence auquel on compare tous les autres cycles, pour évaluer leurs performances. Il est formé successivement de :
|
Fig. 7.5: Cycle moteur de Carnot |
- une transformation isotherme 12 (T2 = cte) - une transformation isentrope 23 (Q23 = 0) - une transformation isotherme 34 (T1 = cte) - une transformation isentrope 41 (Q41 = 0) |
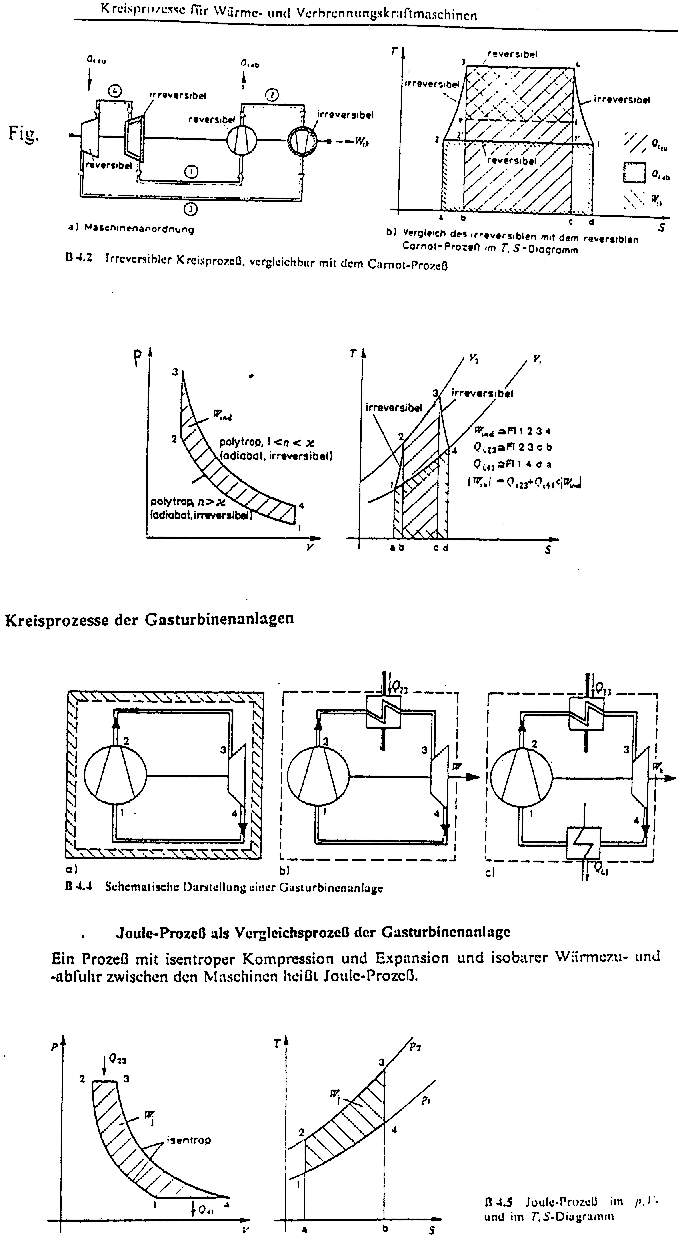
Le travail utile de ce cycle est donnée par :
Wk = å Q = - (Q12 + Q34)
3)
or, Q12 = mrT2lnV2/V1 et Q34 = mrT1lnV4/V3
4)
on peut montrer que, V2V4 = V1V3
d'où, en posant: Q12 = Q2 et Q34 = Q1 on a finalement:
![[ ]](image371.gif)
5)
* On vérifie bien la relation mathématique du deuxième principe selon laquelle å dQ/T = 0 pour un cycle réversible.
*On définit le rendement du moteur de Carnot par le rapport du travail dépensé au cours du cycle sur la chaleur fournie à la machine :
![[ ]](image372.gif)
6)
et comme T2 < T1, le rendement du cycle de Carnot rC < 1
Le cycle de Rankine est à la base des Machines utilisant la vapeur d'eau dans les Centrales thermiques et nucléaires, il comprend (Fig. 7.6):
Le cycle de la vapeur d'eau est une suite de transformations dans des systèmes ouverts successifs (chaudière, turbine, condenseur et pompe d'alimentation...). L'énergie emmagasinée dans les combustibles fossiles ou nucléaires est convertie en travail mécanique pour entraîner soit une turbine (Centrales T + N) soit un moteur à piston (Locomotives à vapeur...). Le processus comprend la vaporisation de l'eau, la détente de la vapeur dans la turbine et sa condensation dans un condenseur.
Si ce cycle de Rankine est modifié par une surchauffe de la vapeur à la sortie de la chaudière on l'appelle alors cycle de Hirn (Fig. 7.7).
|
Fig.7.6: Cycle de Rankine |
Fig. 7.7: Cycle de Hirn avec surchauffe 4-5 |
C'est le cycle du moteur à air chaud qui comprend:
Dans ce processus, de l'air traverse un cylindre en entraînant un piston avec alternativement un apport de chaleur à HT et libération de chaleur à BT et production de travail.
Le cycle de Stirling inverse est à la base des liquéfacteurs de gaz (ex. production d'azote et d'hélium liquide).
![[ ]](p7-8.gif)
Fig. 7.8: Cycle de Stirling
Un cycle peut aussi être réalisé par une succession de systèmes ouverts. Si on veut produire du travail par détente dans une turbine à gaz, il faut ajouter à l'installation un turbocompresseur ou un compresseur à piston et deux échangeurs de chaleur. Ce cycle comprend alors:
![[ ]](p7-9.gif)
Fig. 7.9: Cycle de Joule
| mise en page P. Trau - février 1999 |