Les transformations réversibles d'un système sont des transformations idéales qui jouent un rôle important dans les processus thermodynamiques. On ne considère alors que des processus sans frottement c.à.d sans dissipation d'énergie, qui sont facilement calculables.
Le fonctionnement des machines thermiques est décrit par un cycle thermodynamique, formé de plusieurs transformations successives, qu'on suppose réversibles.
Dans les systèmes fermés, la masse de matière enfermée peut subir différentes transformations. On considère les différentes transformations simples et réversibles suivantes :
Soit un gaz supposé idéal et enfermé dans une enceinte rigide (non déformable dV = 0).
![[ ]](p5-1.gif) |
alors, |
p1V1 = mrT1 p2V2 = mrT2 |
V = cte
dV = 0
|
Fig.5.1 : Transformation isochore |
d'où, |
5.1) |
![]() Travail :
Travail :
on a, dW = -pdV => W12 = -ò 12 pdV
l'enceinte étant indéformable (dV = 0), W12 = 0
5.2)
![]() Chaleur
Chaleur
on a, D U = W12 + Q12
soit, Q12 = U2 - U1 = mcv(T2 - T1)
![]() Energie interne et enthalpie
Energie interne et enthalpie
on a, D U = Q12 + W12 (avec W12 = 0)
soit, l'énergie interne D U = Q12 = mcv(T2 - T1)
5.3)
et l'enthalpie, D H = H2 - H1 = mcp(T2 - T1)
5.4)
![[ ]](p5-3.gif) |
p1V1 = mrT1 p2V2 = mrT2 |
p = cte , dp = 0
|
Fig.5.2 : Transformation isobare |
d'où, => |
5.5) |
![]() Travail
Travail
![[ ]](image351.gif)
d'où, W12 = -p(V2 - V1) = mr(T1 - T2) = aire a12b
5.6)
![]() Chaleur
Chaleur
on a, dH = dQ + Vdp (or dp = 0) => dQ = dH
Q12 = H2 - H1 = mcp(T2 - T1)
5.7)
![]() Energie interne et enthalpie
Energie interne et enthalpie
on a, D U = Q12 + W12
| et | D
U = mcv(T2 - T1) D H = Q12 = mcp(T2-T1) |
5.8) |
|
Fig. 5.3 : Transformation isotherme |
p1V1 = mrT1 p2V2 = mrT2
soit => p1V1 = p2V2
|
5.9) |
![]() Travail
Travail
![[ ]](image352.gif)
W12 = mrTlnp2/p1 = mrTlnV1/V2
5.10)
![]() Chaleur
Chaleur
comme, T = cte et U = f(T) uniquement on a :
Q12 = - W12 = mrTlnp1/p2 (car D U = 0)
5.12)
![]() Energie interne et enthalpie
Energie interne et enthalpie
on a, D U = 0 car, U = f(T)
d'où, D H = 0 car, H = f(T)
5.13)
|
Fig. 5.4 : Transformation isentrope |
or, dU = dQ + dW (et dQ = 0) dQ = dU + pdV = mcvdT + pdV = 0 dQ = dH - Vdp = mcpdT - Vdp = 0 |
5.14) |
soit,
=> mcvdT = - pdV
mcpdT = +Vdp
![[ ]](image353.gif)
En intégrant cette relation, on obtient l'équation bien connue d'un gaz subissant une transformation isentrope :
pVg = cte => ou p1V1g = p2V2g
5.15)
![]() Relations (p,T) et (V,T) pour les grandeurs thermiques
Relations (p,T) et (V,T) pour les grandeurs thermiques
On a les relations : pV = nRT et pVg = cte
5.16)
|
- pour le couple (p,T) : |
|
5.17) |
|
- pour le couple (V,T) : |
|
5.18) |
d'où les relations : T1V1g -1=T2V2g -1 et T1g p11-g = T2p21-g
5.19)
![]() Travail
Travail
![[ ]](image356.gif)
soit, W12 = mr(T2 - T1)/(g -1) = (p2V2 -p1V1)/(1-g )
5.20)
![]() Chaleur
Chaleur
transformation adiabatique, Q12 =0
![]() Energie interne et enhalpie
Energie interne et enhalpie
D U = mcv(T2 - T1)
5.21)
ou, D U = W12
et D H = mcp(T2 - T1) = g D U
![]() pentes comparées des isotherme et isentropes
pentes comparées des isotherme et isentropes
|
Fig. 5.5 : Courbes isotherme et isentrope |
|
* la pente de l'isentrope est plus abrupte que celle de l'isotherme.
La transformation polytrope s'approche davantage d'une transformation réelle, son équation d'état est :
pVn = cte
5.22)
avec, 1<n<g ( ! :attention n n'est pas le nombre de moles, mais un nombre)
*Formules :
on a, p1V1n = p2V2n
![[ ]](image359.gif)
5.23)
et, ![[ ]](image360.gif)
5.24)
*Attention ! : pour une polytrope
|
Q12 ¹ 0 et, |
Q12 = D U - Wpol12
|
* Ces transformations (sauf la polytrope) sont des transformations idéales qui s'écartent des transformations réelles, mais elles sont très utiles pour modéliser ou décrire les cycles thermodynamiques.
* La formule pVn = cte est très générale et englobe toutes les transformation précédentes :
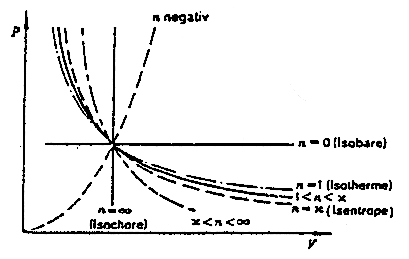
Fig. 5.7 : Les différentes transformations en (p,V)
La plupart des processus thermodynamiques sont réalisés dans des systèmes ouverts où un fluide (de débit massique qm) entre dans le système et le quitte. Le fluide dans ce système subit différentes transformations par suite d'échange d'énergie avec le milieu extérieur.
On ne considèrera que des processus stationnaires et réversibles en négligeant les variations d'énergies cinétique et potentielle du fluide (D Ec = D Ep = 0) dans le système. Le calcul des grandeurs thermiques et calorifiques dans ces systèmes ouverts est aussi effectué à partir des relations précédentes appliquées aux systèmes fermés : car ces grandeurs sont indépendantes de la nature des variations d'état du système.
Dans les systèmes ouverts, on distingue entre les processus d'écoulement et de travail (voir Fig. 5.8) :
=> pour ces processus, on ne détermine que les échanges de chaleur
Exemples de tels processus : les échangeurs et les tuyaux de transfert
=> pour ces processus réversibles, il suffit de déterminer le travail technique
Exemples de tels processus : les turbines, compresseurs et moteurs à pistons
![]() Travail technique
Travail technique
Les formules suivantes ne sont valables que pour des énergies cinétique et potentielles constantes et un gaz idéal :
- transformation isochore
Wt12 = ò 12 Vdp = V(p2 - p1) = mr(T2 - T1)
5.27)
- transformation isobare
Wt12 = 0 (car dp = 0)
- transformation isotherme
Wt12 = ò 12 mrdp/p = mrTlnp2/p1 = Wv12
5.28)
- transformation isentrope
Wt12 = H2 -H1 = mcp(T2- T1)
5.29)
- transformation polytrope
Wtpol12 = n Wvpol12
5.30)
* Il apparaît que la transformation isotherme est la plus souhaitable, car :

![]() Systèmes Fermés
Systèmes Fermés
Ex1 : Enceinte fermée. Dans une enceinte sphérique de 20 m3 se trouve de l'azote sous une pression de 10 bar et à une température de 25 °C. On rajoute 10 kmoles d'azote avec pour résultat que la température monte à 70 °C. Ce processus se déroule rapidement de sorte qu'alors on peut considérer l'enceinte comme étant adiabatique. Ensuite, la température de l'enceinte chute de nouveau à 25 °C par cession de chaleur à l'environnement. On considérera la chaleur massique comme constante au cours des transformations et on prendra sa valeur à t = 0 °C.
a) Masse d'azote avant et après remplissage
b) Pression juste après le remplissage
c) Comment varie la pression et l'énergie interne après le refroidissement
d) Quelle est la chaleur cédée à l'extérieur après le remplissage
Rép : a) m1 = 226 kg et m2 = 506 kg b) p2 = 25,8 bar c) p3 = 22,4 bar D U = - 16,895 kJ d) Q = - 16,895 kJ
Ex2 : Moteur Diesel. Dans le cylindre d'un moteur à combustion se trouve 1 g d'air à 45 bar et 590 °C. Au cours de la détente du gaz, on injecte du carburant qui brule en dégageant une énergie de 2 kJ : cette injection est réglée de manière à maintenir la pression constante dans le cylindre. On négligera la variation de masse et de composition du gaz, et on prendra pour la chaleur massique une valeur moyenne. Le processus est considéré comme réversible
a) Evaluer les grandeurs thermiques avant et après injection
b) Quel est le travail volumétrique du piston, expliquez son signe
c) Calculer les variations d'énergie interne et d'enthalpie
Rep : a) V1 = 55,1 cm3, T2 = 2508 K (2235 °C), V2 = 160 cm3 et p2 = 45 bar b) W12 = - 472 J c) D H = 2 kJ D U = 1,53 kJ
Ex3 : Dans un cylindre isotherme de 10 l, refroidi par une circulation d'eau, on comprime réversiblement à température constante de l'air à 1bar d'abord à 1l, puis à 0,1 l.
a) Quel est le travail volumétrique nécessaire à chacune de ces compressions
b) Quelle quantité de chaleur est chaque fois mise en jeu
c) Comment varie la pression, l'énergie interne et l'enthalpie, expliquer
d) Comment varie ces différents résultats si à la place de l'air on utilise de l'hydrogène
Rep : a) W12 = 2,3 kJ et W23 = 2,3 kJ b) Q12 = - 2,3 kJ et Q23 = -2,3 kJ c) p2 = 10 bar p3 = 100 bar et D U = D H = 0 , expliquer d) la nature du gaz ne change pas les données, expliquer
Ex4 : Dans un cylindre adiabate de 10 l, on comprime grâce à un piston de l'air au départ à 1 bar d'abord à 1 l puis à 0,1 l de façon réversible. On négligera la variation des chaleurs massiques avec la température, en prenant les valeurs à 0 °C.
a) Quel est le travail volumétrique à chaque compression
b) Comment varie à chaque compression partielle les grandeurs thermiques et caloriques
Rép : a) W12 = 3,78 kJ et W23 = 9,49 kJ
b) p2 = 25,1 bar et m = 0,0121 kg, T2 = 723 K (450 °C)
p3 = 630 bar, T3 = 1817 K (1544 °C)
D
U12 = 3,78 kJ et D
H12 = 5,30 kJ
D
U23 = 9,49 kJ et D
H23 = 13,3 kJ
Ex5 : Dans le cylindre d'un moteur à combustion se trouve 1 g d'air sous 29,5 bar à 945 °C. Au cours de la détente du gaz, on injecte un carburant qui s'enflamme : ce processus réversible se fait selon une transformation polytrope de coefficient n = - 1 et la pression grimpe à 38,2 bar. On négligera les variations de masse et de composition, mais on tiendra compte de la variation des chaleurs massiques en fonction de la température, pour calculer cpm [T1, T2].
a) Déterminer les grandeurs thermiques avant et après l'injection
b) Evaluer le travail volumétrique du piston
c) Evaluer les variations d'énergie interne et l'enthalpie
d) Quelle est l'énergie apportée par la combustion du carburant
e) Représenter la transformation dans un diagramme (p,V)
Rép : a) V1 = 118,6 cm3 , T2 = 2040 K (1767 °C) , V2 = 153,6 cm3
b) W12 = -118 J c) D
H = 1003 J et D
U = 767 J , expliquer les signes
d) Q12 = 885 J , vérifier le bilan d'énergie du système
Ex6 : Une masse de 5 kg d'hélium se détend de façon polytrope et réversible dans un système fermé de 10 bar et 400 °C à 2 bar et 120 °C.
a) Quel est le coefficient n de cette détente polytrope
b) Evaluer le travail volumétrique échangé
c) Quelle quantité de chaleur est fournie ou cédée
d) Comment varient l'énergie interne et l'enthalpie du système
Rép : a) n = 1,5 b) W12 = - 5,82 MJ c) Q12 = 1,41 MJ
d) D
U = - 4,41 MJ et D
H = - 7,34 MJ
![]() Systèmes Ouverts
Systèmes Ouverts
Ex7 : Dans un compresseur on comprime 10 l d'air initialement à 1 bar et 15 °C jusqu'à 10 bar et ensuite à 100 bar de façon réversible. Cette compression s'effectue soit :
1) à température constante
2) dans un compresseur adiabate
3) selon un processus polytrope avec n = 1,2
On négligera la dépendance en température des chaleurs massiques et aussi les variations d'énergies cinétique et potentielle du fluide.
On évaluera pour chacune des compressions partielles et dans les 3 cas 1) à 3) :
a) Le travail technique
b) La quantité de chaleur fournie ou cédée
c) Les variations d'énergie interne et de l'enthalpie
d) Représenter dans un diagramme les différentes transformations en y indiquant l'aire associée au travail technique
Rép : a) Transformation isotherme
1) Wtith12 = + 2,3 kJ et Wtith23 = + 1,41 kJ
2) Qith12 = - 2,3 kJ et Qith 23 = - 2;3 kJ
3) D
U12 = 0 et D
U23 = 0 et D
H 12 = 0 et D
H23 = 0
b) Transformation adiabate (isentrope)
1) Wtisen12 = + 3,26 kJ et Wtisen23 = + 6,32 kJ
2) Qisen12 = 0 et Qisen23 = 0
3) D
U12 = 2,33 kJ et D
U 23 = 4,51 kJ et D
H12 = 3,26 kJ et D
H23 = 6,32 kJ
c) Transformation polytrope
1) Wtpol12 = + 2,80 kJ et Wtpol23 = + 4,12 kJ
2) Qpol12 = - 1,165 kJ et Qpol23 = - 1,72 kJ
3) D
U12 = 1,165 kJ et D
U23 = 1,72 kJ , D
H12 = 1,635 kJ et D
H23 = 2,40 k kJ
| mise en page P. Trau - février 1999 |